Nach der Implantation der Blastozyste (während der 2. Woche) stellt sich der Embryo als eine flächige, zweilagige Scheibe dar (ekto- und enetodermale Oberfläche). Durch Zellverschiebungen während der Gastrulation wird das mittlere Keimblatt (Mesoderm) gebildet und dadurch die Voraussetzung für den dreidimensionalen Bau des zentralen Nervensystems geschaffen.
1. Neurulation
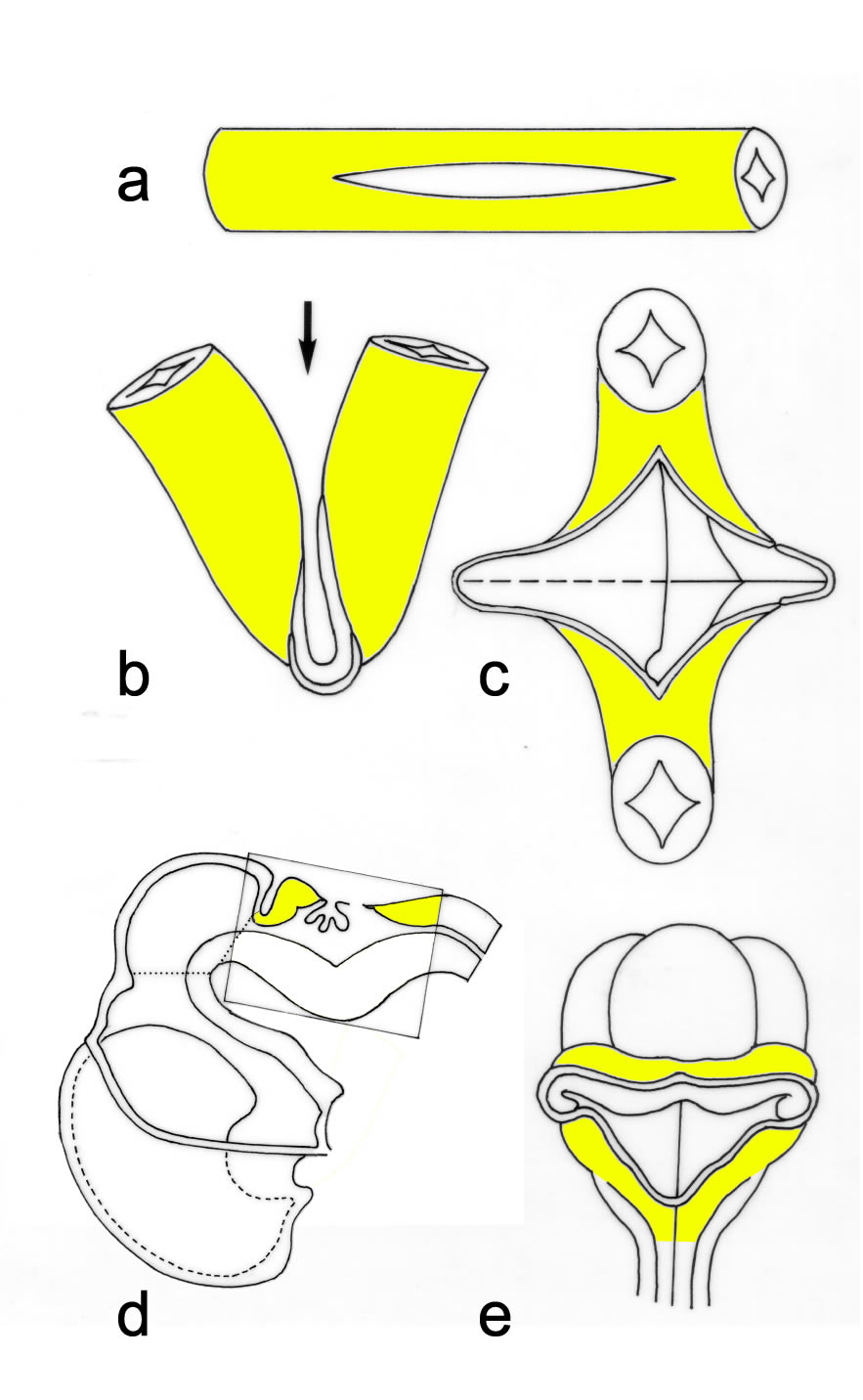
Die Anlage des gesamten Nervensystems wird dadurch gebildet, daß das mittig gelegene Ektoderm (Neuralplatte), das während des Gastrulationsvorganges von der Chorda-Mesodermmaterial unterwandert wurde, abgesenkt und als Röhre geschlossen wird. Dieser Prozess (Neurulation) erfolgt in Etappen, die sich natürlich räumlich und zeitlich gegenseitig etwas überlappen (Abb. 2-1):
- Die Verdickung des Ektoderms zur Neuralplatte.
- Die Bildung der Neuralwülste und Einwölbung der Neuralplatte zur Neuralgrube.
- Der Verschluß der Neuralgrube zum Neuralrohr.
- Die Bildung der Neuralleiste (aus einer Zellzone zwischen der Neuralgrube und dem angrenzenden Oberflächenektoderm).
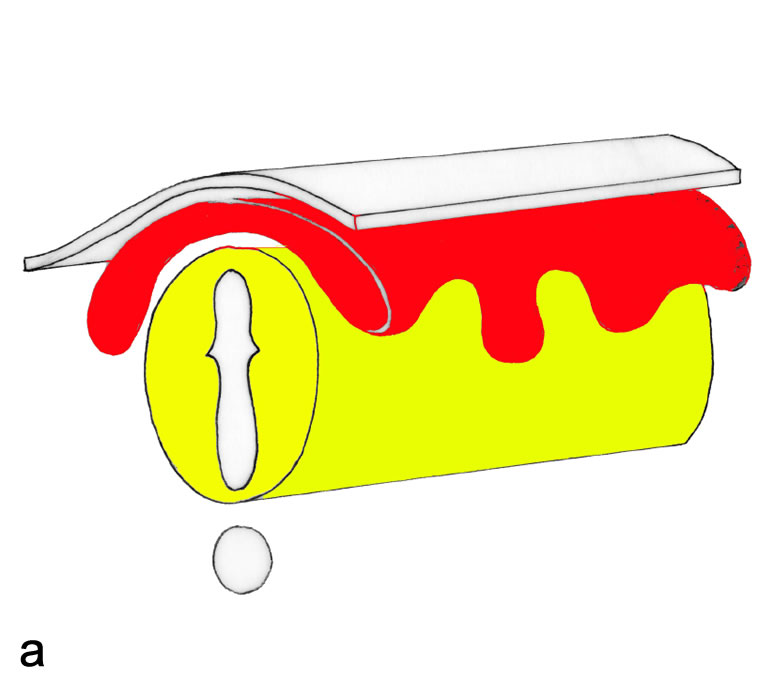
Legende
a, Aufsicht auf die Keimscheibe eines Embryos (während der 3. Woche), die zu diesem Zeitpunkt noch flächig ausgebreitet ist. Bereits zu diesem Entwicklungsstadium sind die Hauptabschnitte des Nervensystems weitgehend festgelegt.
b, Schematische Darstellung eines Embryos (zu Beginn der 4. Woche).
S1-S4 Kennzeichnen die Schnittebenen der nebenstehenden vier Abbildungen, die den Neuralisationsprozess veranschaulichen.
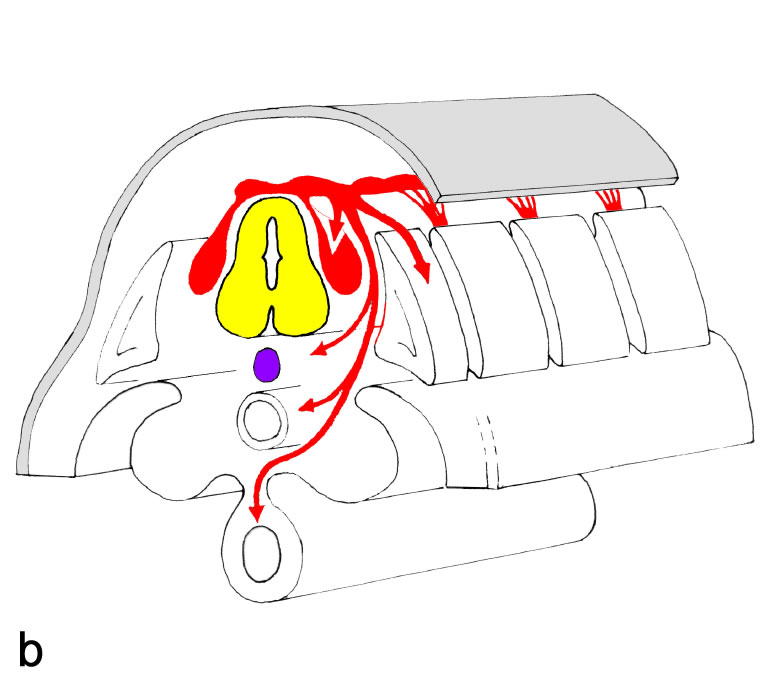
Legende
Aus der anfangs (weitgehend) zusammenhängenden Leiste schwärmen die Zellen aus und verteilen sich im gesamten
Körper. Diese Wanderung erfolgt in zwei Richtungen:
a. Einige Zellen verbleiben oberflächennah, dringen in die Haut ein und werden dort zu Melanozyten.
b. Andere Zellen strömen in die Tiefe. Aus ihnen gehen die sympathischen Ganglien und das Nebennierenmark hervor. Aus den verbleibenden segmental angeordneten Zellgruppen entwickeln sich u.a. die sensiblen Ganglien des Rückenmarks und der Hirnnerven (CN V, VII, IX, X).
Mit dem Schluss des Neuralrohres ist die Anlage des NS vollzogen. Aus dem Neuralrohr entwickelt sich das ZNS; sein Lumen wird zum Ventrikelsystem des Gehirns und Rückenmarks. Die Neuralleiste bildet eine vorübergehende Anlage; sie erschöpft sich in der Bildung des peripheren Nervensystems, das völlig von der Neuralleiste abstammt, und verschiedener differenzierter Zellinien (Hüllzellen der peripheren Nerven, weiche Hirnhäute, Pigmentzellen, Zellen des Nebennierenmarks, Komponenten des Kopfmesenchyms, u.a.).
Das Neuralrohr wird zum ZNS; aus der Neuralleiste entsteht das periphere Nervensystem.
2. Entwicklung von Nervenzellen
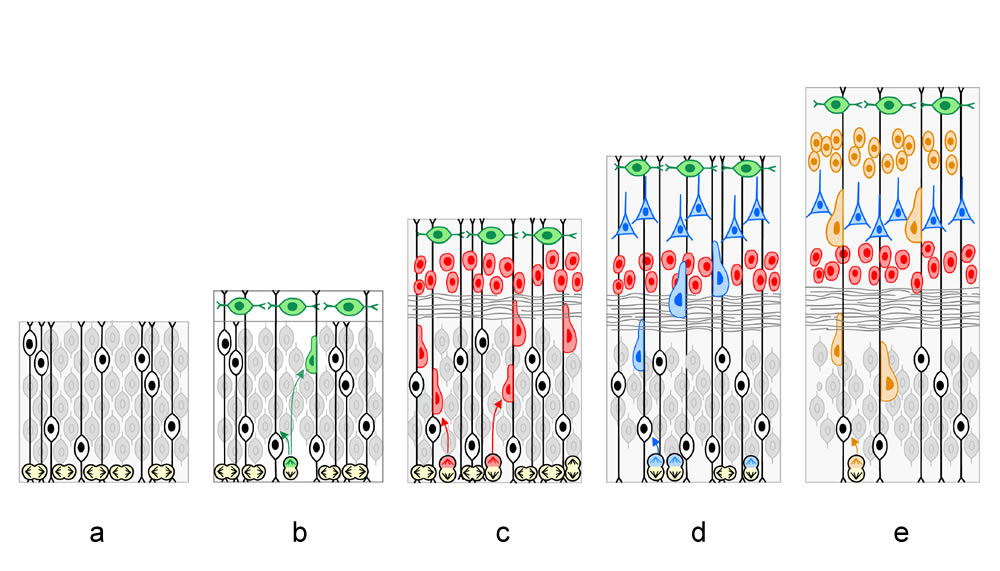
Während der Entwicklung des ZNS können 4 zelluläre Grundprozesse beschrieben werden. Sie folgen einander mit mehr oder weniger großen zeitlichen Überschneidungen (Tabelle 1).
-
Zellvermehrung (Neurogenese):
Die Bildung und Reifung der primitiven Vorläuferzellen (Neuroblasten) zu funktionierenden Neuronen. -
Zellwanderung (Migration):
Die Wanderung der Neuroblasten vom Ort der letzten Zellteilung (ihrem Geburtsort) zu ihrem Funktionsort. - Zellreifung (Neuronale Differenzierung, Synaptogenese und Bildung von Schaltkreisen):
Während der Synaptogenese werden zunächst provisorische Kontakte geknüpft. Erst wenn dauerhafte Verbindungen mit definierten Partnern zustande kommen, werden diese stabilisiert. -
Modifizierung von Verbindungen:
Nervenzelltod, Reorganisation von Verbindungen.
Legende
a. Querschnitt durch das geschlossene Neuralrohr.
b. Ausschnitt aus der Wand des Neuralrohrs mit den
wichtigsten Zellen. Aus der Ventrikelzone entstehen zunächst undifferenzierte Neurone (gelb), Glioblasten (blau),
sowie Ependymoblasten (grün). Die postmitotischen Neurone und Glioblasten verlieren ihren Kontakt zur luminalen
Oberfläche und wandern zur Mantelzone, wo ihre Differenzierung beginnt. Aus den Glioblasten entwickeln sich
Oligodendrogliazellen, Vorläufer der Astrozyten, und radiale Gliazellen. Aus den Ependymoblasten gehen
Ependymzellen, Zellen des Plexus choroideus und einige Spezialzellen hervor.
Modifizierung von Verbindungen: Nervenzelltod:
Die morphologische, physiologische und neurochemische Differenzierung von Neuronen ist ausschlaggebend für ihr zielgerichtetes Funktionieren. Jede Zelle, die ihre persönliche Identität nicht erreicht, stört den Leistungsumfang des neuronalen Netzwerkes und wird eliminiert. Der während der Differenzierung des NS stattfindende massive (physiologische) Zelluntergang (Selbstmord) wird als Apoptose bezeichnet.
Während der Entwicklungsphase dient die Apoptose hauptsächlich der Kompensierung von Fehlentwicklungen ("Irrläufern" der Ontogenese) und der Anpassung der Neuronenzahl an die Größe der innervierten Territorien; aber auch fokale Läsionen während der Entwicklung scheinen durch Signale, die durch Apoptose ausgelöst werden, repariert zu werden. Die Beeinträchtigung dieses Prozesses, der für die normale Entwicklung notwendig ist, führt zu vielfältigen und gut charakterisierten Defekten.
3. Entwicklung von Gliazellen
Alle Gliazellen, mit Ausnahme der Mikroglia, stammen vom Neuroektoderm ab
- Die zentrale Glia entstammt Glioblasten, die aus der Neuroepithelialschicht auswandern und sich zu Astrozyten und Oligodendrozyten differenzieren. Die Bildung von Gliazellen hält (im Gegensatz zu der von Neuronen) durch das gesamte Leben an.
- Die periphere Glia stammt aus der Neuralleiste
- Ein dritter Gliazelltyp, die Mikroglia entstammt dem haematopoetischen System (Makrophagen des Gehirns).
4. Zell-Zellinteraktion während der Entwicklung
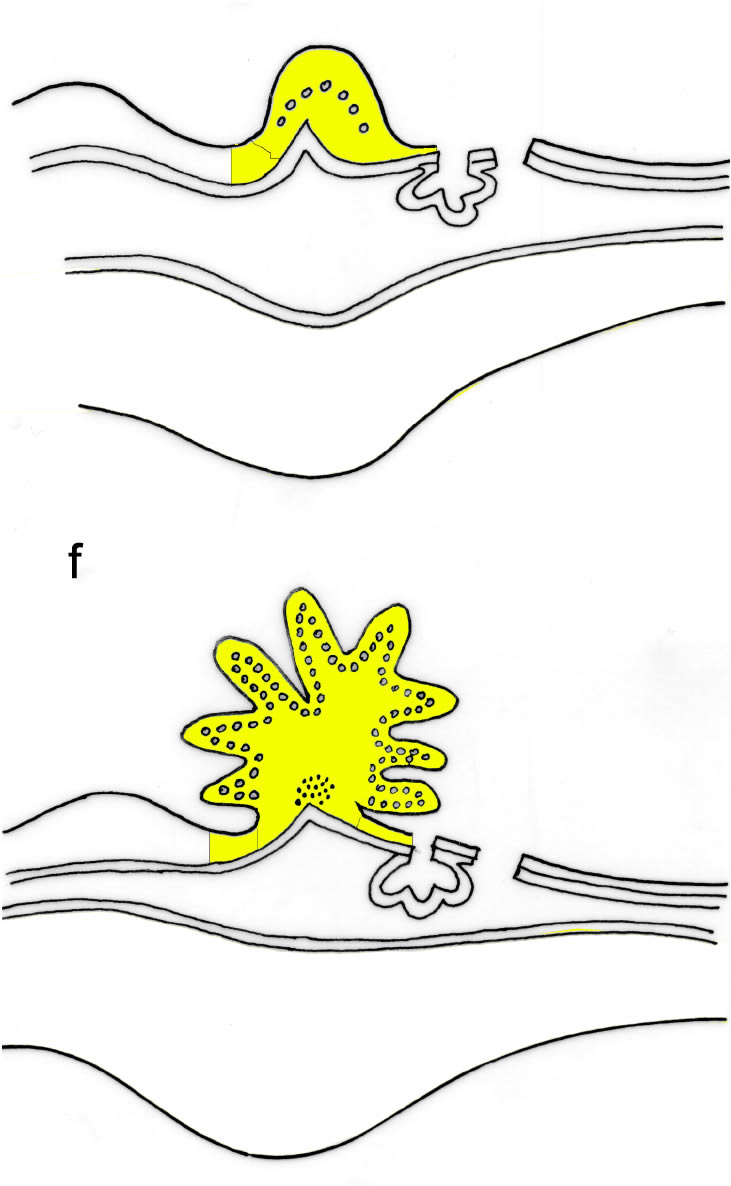
Zellsortierung und Kollektivbewegungen von Zellverbänden beruhen nicht nur auf der Fähigkeit der Zellen zu wandern; vielmehr müssen innerhalb dieser Beziehungsgefüge Kontakte gebildet und wieder gelöst werden. Der Wechsel von Zellpaarung (Adhäsion) und Trennung (Dishäsion, Repulsion) wird durch sog. (Zell-Zell-) Adhäsionsmoleküle vermittelt.
Abb. 2-4: Zeitliche Änderung der Oberflächen-Adhäsivität während der Gastrulation und Neurulation (exemplarisch dargestellt am Beispiel Expression von drei Molekülvarianten aus der Familie der sog. Kadherine beim Hühnchenembryo).
Legende
a. Zu Beginn der Gastrulation besteht der Embryo aus zwei Zellschichten, dem
Ento- und Ektoderm, die beide E-Kadherin (grün) exprimieren. Im Mittelteil des Bildes verlieren Zellen das E-Kadherin; sie lösen
sich aus dem Gewebeverbund und schieben sich (als prospektives Mesoderm) zwischen die beiden Keimblätter
(dreikeimblättrige Keimscheibe). Während dieser Phase müssen die wandernden Mesodermzellen eine wechselnde "Klebrigkeit"
sowohl zum Ento- und Ektoderm besitzen, damit sie gezielt gleiten und sich lokal aggregieren können.
b. Nach vielen
Zellteilungen verliert das Segment der Ektodermzellen, das sich über der Chorda dorsalis (violett) befindet, die Fähigkeit zur
Bildung von E-Kadherin. Diese Zellen synthetisieren nun N-Kadherin (gelb), bleiben untereinander kohärent, falten sich
einwärts und bilden die Neuralgrube.
c. An der Grenze zwischen Ektoderm (produziert E-Kadherin) und Neuralgrube
(produziert N-Kadherin) verlieren einige Zellen alle Kadherine und beginnen aus dieser Region auszuwandern um die
Neuralleiste zu bilden. Höchstwahrscheinlich bildet der Verlust der Zelloberflächenproteine die Vorraussetzung für die
Wanderungsfähigkeit der Neuralleistenzellen (blau). Zu dem Zeitpunkt, wo sie an ihrem Bestimmungsort angekommen sind,
Zellaggregate bilden und sich (z.B. zu Ganglien) differenzieren, re-exprimieren sie wieder Adhäsionsmoleküle
(N-Kadherin).
d. Nach Abschluß der Neurulation und Bildung eines geschlosssenen Epithels exprimieren die Ektodermzellen
sowohl E- wie auch P-Kadherine (orange); der Chordafortsatz exprimiert sowohl N- als auch P-Kadherine (violett). Zur
Zeit der Kondensierung von mesodermalen Zellen in Somiten exprimieren diese N-Kadherine. Andere Gewebearten, wie z.B.
Endothelzellen der Blutgefäße (rot) zeichnen sich durch die Expression anderer Adhäsionsmoleküle aus
(nach Takeichi,
1988).
Bitte auf den Pfeil im Bild klicken
5. Entwicklung des Rückenmarks
Aus dem kaudalen Abschnitt des Neuralrohres entsteht das Rückenmark. Die Wand des Neuralrohres wird anfänglich
von einem hohen Zylinderepithel ausgekleidet. Die dem späteren Zentralkanal zugewandten (luminalen)
Zellschichten werden zur Matrixschicht (Intermediär- oder Mantelzone) aus der die graue Substanz
hervorgeht. Peripher hierzu bildet sich die Marginalschicht. Sie enthält die Nervenfasern, die aus den
Neuroblasten der Matrixzone stammen. Später, wenn diese Fortsätze ihre Markscheide erhalten, nimmt die
Marginalschicht allmählich ein weißes Erscheinungsbild an und wird dann als weiße Substanz des
Rückenmarks bezeichnet.
Im Neuralrohr findet in den seitlichen Abschnitten eine wesentlich
stärkere Zellvermehrung statt als in den dorsalen und ventralen Bereichen. Infolgedessen erscheinen dort bald
stark verdickte Seitenplatten, die dorsal durch eine schmale Deckplatte und ventral durch eine
schmale Bodenplatte miteinander verbunden sind. Sie enthalten keine Neuroblasten und dienen hauptsächlich dem
Durchtritt von Axonen, die von einer zur anderen Seite kreuzen (Abb. 2-5).
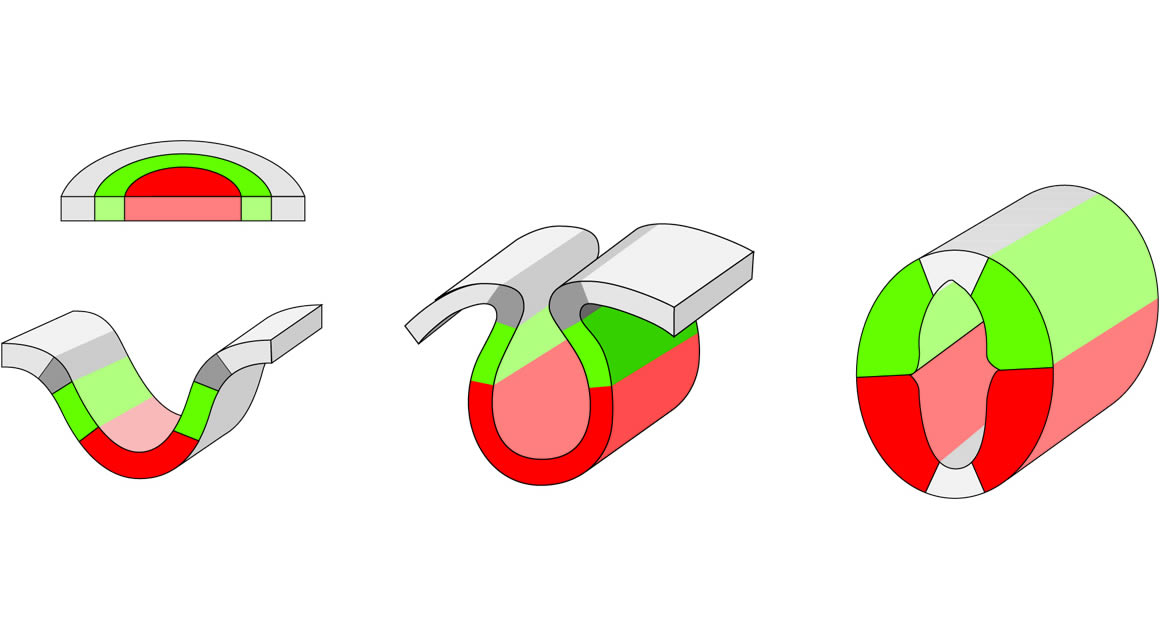
Legende
Prozeß der Neurulation auf der Ebene des Rückenmarks. Aus der die Chorda dorsalis
überlagernden Region der Neuralplatte entsteht die motorische Region des Rückenmarks (rot), aus den seitlich
gelegenen Bezirken, die sensible Region (grün).
Dunkelgrau: Primordium (Anlage) der Neuralleiste.
Gleichzeitig mit der Dickenzunahme der Seitenplatten erscheint an der Innenfläche eine Längsfurche (Sulcus limitans). Sie markiert die Grenze zwischen der motorischen Region (ventrale Grundplatte) und der sensiben Region (dorsale Flügelplatte). Der Sulcus limitans reicht bis an die Spitze des Vorderhirns (Lamina terminalis) (Abb. 2-5). Diese Gliederung des Neuralrohres ist in morphologischer und funktioneller Hinsicht von großer Bedeutung.
Legende
In den Anfangsstadien der Entwicklung hat das Gehirn noch die gleiche Grundstruktur wie das Rückenmark. Während der frühembryonalen Entwicklung läßt sich eine segmentale Gliederung des Gehirns nachweisen. Es werden 7 Abschnitte des Rautenhirns (sog. Rhombomere, R1-7), 6 Abschnitte des Vorderhirns (sog. Prosomere, P1-6) und 2 Zwischenabschnitte (Mittelhirn, M und Isthmus, Is) beschrieben. Mit der Ausbildung der Hirnbeugen und dem damit verbundenen unterschiedlichen Wachstum von grauer und weißer Substanz zeigen sich jedoch zunehmende Unterschiede in den verschiedenen Hirnabschnitten.
6. Entwicklung des Gehirns
Zunächst ähnelt das Neuralrohr auch im vorderen Abschnitt noch einem Schlauch. Doch noch bevor es vorne geschlossen ist, treten dort drei Erweiterungen auf, die sich zu den primären Hirnbläschen entwickeln. Das am weitesten vorn gelegene Bläschen entspricht dem späteren Vorderhirn; das zentral gelegene dem Mittelhirn und das hinten gelegene Bläschen dem Rautenhirn (Hinterhirn). Ungleiche Wachstumsraten, Zellwanderung und die wechselnden Beziehungen zum umgebenden Mesenchym führen während der folgenden Entwicklungsschritte zu Beugen (Flexuren), Einstülpungen (Invaginationen), Ausstülpungen (Evaginationen). Nach außen gerichtetes Wachstum (Ausstülpung) führt zur Bildung der paarigen Großhirnbläschen, Augenbecher und Riechkolben sowie der unpaaren Neurohypohyse und Epihyse. Nach innen gerichtetes Wachstum führt zur Bildung der Ganglienhügel aus denen u.a. das Striatum und der Mandelkern hervorgehen. Gleichzeitig mit dem Auftauchen der Bläschen (5 mm Embryo) krümmt sich das Neuralrohr nach ventral und bildet 2 Beugen: Eine vordere Beuge liegt im Bereich des Mittelhirns (Scheitelbeuge, kephale Flexur); eine hintere Beuge liegt am Übergang vom Rückenmark zum Hinterhirn (Nackenbeuge, zervikale Flexur).
Sämtliche sensiblen (rezeptorischen) Anteile des ZNS werden in der Flügelplatte entwickelt und sämtliche motorischen (effektorischen) in der Grundplatte.
Abb. 2-7: Gliederung des Neuralrohrs und Formentwicklung des Gehirns
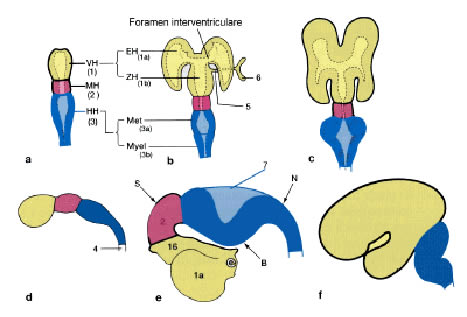
1. Vorderhirn (1a, Telencephalon, 1b, Zwischenhirn),
2. Mittelhirn ,
3. Hinterhirn (3a, Metencephalon, 3b, Myelencephalon),
4.Rückenmark,
5.Augenbecherstiel,
6.Augenbecher,
7.Dach des IV. Ventrikels,
S: Scheitelbeuge,
N: Nackenbeuge, B: Brückenbeuge.
Entwicklung des Hirnstamms:
Der allgemeine Bauplan des Rückenmarks setzt sich auch im Hirnstamm fort. Wie dort liegen die Zellkörper sensibler und koordinierender Neurone dorsal, während die der Motorneurone ventral liegen (Abb. 2-7). Da sich das Gehirn im Laufe der Entwicklung jedoch stark spezialisiert, bilden Zellen der Mantelschicht (graue Substanz) mit ähnlicher Funktion keine Säule, wie im Rückenmark, sondern verdichten sich zu Kernen (Nuclei). Auch hier gilt die Regel, wonach die sensiblen koordinierenden Kerne aus dem dorsalen Teil der Mantelschicht entstehen und die motorischen Kerne aus dem ventralen Teil, also der Grundplatte. Allerdings werden einige Strukturen, die im Dienst der Motorik stehen aus dem dorsalen Teil entwickelt: Ncl. ruber, Substantia nigra, Nuclei pontis, Ncl. olivaris inf. und Kleinhirn (Abb. 2-8).
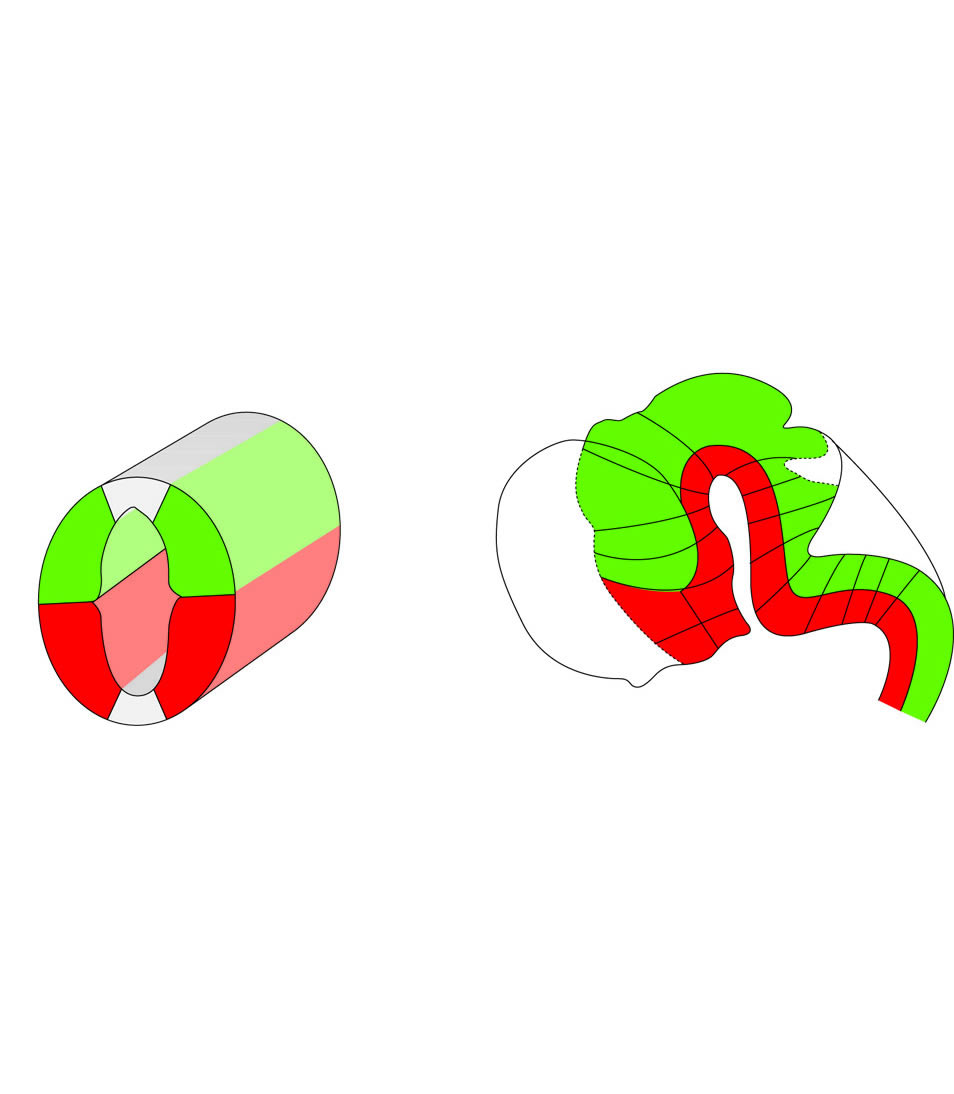
Abb. 2-8: Entwicklung des Hirnstamms unter Betonung der rostro-kaudalen und medio-lateralen Segmentierung

Legende
links:
Die Flügelplatte als Sitz sensibler und koordinierender Kerne liegt dorsal und ist durch den Sulcus limitans von der Grundplatte, dem Sitz motorischer Kerne, deutlich abgegrenzt.
rechts:
Querschnitte durch Mittelhirn, Pons und verlängertes Mark während der 10. Woche.
Entwicklung des Kleinhirns: Das Kleinhirn entwickelt sich aus zwei knospenartigen Auswüchsen der seitlichen Flügelplatte des Metencephalons (Abb. 2-8d, Abb. 2-9). Diese wachsen aufeinander zu und lassen an ihrer Verschmelzungsstelle den späteren Wurm erscheinen. Während das Rautenhirn in der Brückenregion knickt und der Boden des 4. Ventrikels seitlich/quer ausgezogen wird, stellt sich auch die Kleinhirnanlage quer und erscheint als plattenartiger Fortsatz, der sich von vorne über das dünne Dach des 4. Ventrikels stülpt (Abb. 2-9).
Legende
a-c Mechanisches Modell zur Veranschaulichung der Bildung der Rautengrube als Folge der Entwicklung der Brückenbeuge.
a, Gestrecktes, dorsal geschlitztes flexibles Rohr. (Die Öffnung entspricht dem Dach des 4. Ventrikels).
b, Geknicktes Rohr in der Seitenansicht.
c, Aufblick von dorsal auf die "Rautengrube" (vgl. Pfeil in b).
d, e, Darstellung eines Fötalgehirns in Seiten- und in Dorsalansicht nach der Bildung der Brückenbeuge.
f, Median-Sagittalansicht des in d abgebildeten Gehirns. Der markierte Ausschnitt bezeichnet die Lage der in den beiden folgenden Abbildungen gewählten Ausschnitte, die die weitere Entwicklung des Kleinhirns Gestationswoche darstellen.
Entwicklung des Neocortex
(Abb. 2-9). Aus den beiden seitlichen Ausstülpungen des Vorderhirnbläschens (Großhirnbläschen) entstehen die Großhirnhemisphären. Der Wandaufbau entspricht zunächst dem des Neuralrohrs. Mit Beginn der Wanderung der (postmitotischen) Neurone entwickelt sich wie im Rückenmark die Intermediärzone. Wenn sich die Zellen der Intermediärzone ab dem dritten Entwicklungsmonat am Übergang zur Marginalzone zu differenzieren beginnen, entsteht hier allerdings (neben der Ventrikelzone, Intermediärzone/Mantelzone und Marginalzone) eine weitere Zone, die als Rindenzone (Kortexplatte) bezeichnet wird. Diese fetale Schichtung wird ab der 25. Gestationswoche einer Umwandlung unterzogen, die bis zur Geburt andauert. Erst nach der Geburt findet die Ausreifung des Kortex statt und damit zeigt sich auch histologisch der typische Rindenaufbau. Obgleich der ontogenetische Bauplan des Neocortex im Prinzip in allen Regionen gleich ist, finden sich in der endgültigen Ausgestaltung der verschiedenen Regionen mehr oder weniger große Unterschiede, die eine Abgrenzung der Hirnregion nach zytoarchitektonischen, myeloarchitektonischen und biochemischen Gesichtspunkten erlaubt. (Kap. 15-2, Abb. 2-2).
Legende
a, Zustand unmittelbar nach Schluß des Neuralrohrs. Einige Neurone werden postmitotisch und wandern (geleitet von den radialen Gliafasern) in die Intermediärzone/Mantelzone, wo sie zunächst in Wartestellung verharren.
b, c, Die Zellen der Intermediärzone wandern schließlich erneut um nun ihre endgültige Position einzunehmen. Diejenigen Zellen, die zuerst wandern, bilden die tiefsten Kortexschichten (L6).
d, Zellen, die später wandern, ziehen an den früher gestarteten Partnern vorbei und finden ihr Zielgebiet im Kortex zunehmend weiter oberflächennah (L5, L4, etc.). Damit werden die älteren Zellen von den Neuankömmlingen nach unten abgedrängt und die ältesten Zellen liegen somit in den tiefen, die jüngsten in den oberflächennahen Schichten des Kortex. (Eine Ausnahme hierzu bildet nur die die spätere Lamina 1 direkt unterhalb der pialen Oberfläche, die sich aus der Marginalzone entwickelt hat).
Windungen (Gyri) und Furchen (Sulci) finden sich ab der 2. Hälfte der Schwangerschaft. Zuerst werden die seitliche Querfurche (Sulcus lat.), die Zentralfurche (Sulcus centralis), der Sulcus parieto-occipitalis und der Sulcus collateralis erkennbar (siehe Kap. 15). Sie werden als Primärfurchen (oder auch als Fissuren) bezeichnet und können zur Reifungsbestimmung des Gehirns herangezogen werden.
7. Fehlbildungen
Während des Neurulationsstadiums wird die Anlage des gesamten Nervensystems gebildet. Eine Änderung, Hemmung oder Fehlbildung des Neurulationsprozesses führt zu Defekten der Neuralröhre, die sich aus der Entwicklungsgeschichte leicht erklären lassen.
Abb. 2-12: Die wichtigsten Störungen des Schließungsprozesses der primären Neuralrinne in Rückenmark und Gehirn

Legende
a, b, Normalzustand,
c, d, Lokale Spaltbildungen der Wirbelsäule oder der Schädelkapsel bei unvollständigem Verschluß, ohne Fehlbildungen von Gehirn und Rückenmark.
e, f, Vorfall der Meningen durch einen Wirbelsäulen- oder Schädeldefekt.
g, h, k, Vorwölbung von Rückenmark- bzw. Gehirnabschnitten einschließlich der Meningen durch einen Defekt der Wirbelsäule oder des Schädels.
i, Unterbliebener Verschluß der Neuralgrube (Myelocele bzw. Rachischisis). Offen liegendes Nervengewebe ohne Hautbedeckung im Bereich der Wirbelsäule (Spina bifida). Punktierung: Knochen; grau getönt: Rückenmark bzw. Gehirn, dicke Linie: Dura mater, 1, Liquorraum, 2, Neuralplatte, 3, Haut.
8. Zusammenfassung
Während der Neurulation wird die Anlage des gesamten Nervensystems gebildet.
Während der Entwicklung des ZNS können auf zellulärer Ebene 4 zelluläre Grundprozesse beschrieben werden: Zellvermehrung (Neurogenese), Zellwanderung (Migration), neuronale Differenzierung und Modifizierung von Verbindungen.
Für die Zellverschiebungen während der Entwicklung sind Zell-Zell-Interaktionen nötig. Zellpaarung (Adhäsion) und Trennung (Dishäsion) werden dabei durch sog. Adhäsionsmoleküle vermittelt.
Die Neuralleiste ist eine vorübergehende Struktur, die sich aus den seitlichen Anteilen der Neuralplatte ableitet. Ihre Zellen legen eine große Wanderung zurück um bestimmte Areale des Organismus zu erreichen und sich dort in sehr unterschiedliche Zelltypen zu differenzieren.
Gehirn und Rückenmark bestehen während der frühen Embryonalphase aus Neuroepithelial-, Matrix- und Marginalschichten.
Das Gehirn leitet sich aus den 3 primären Hirnbläschen ab.
Das Ventrikelsystem entwickelt sich aus dem Lumen des Neuralrohrs. Es ist mit Liquor gefüllt.