1. Eigenschaften von NTM-Neuronen
Als Neurotransmitter (NTM) werden Substanzen bezeichnet, die aus präsnaptischen Strukturen auf einen Nervenimpuls hin freigesetzt werden und mit Rezeptoren der postynaptischen Membran reagieren. Während im peripheren NS hauptsächlich Acetylcholin und Noradrenalin eine große Rolle spielen und dort an typische Elemente gebunden sind, ist die Situation im Gehirn komplizierter und unübersichtlich. Zum einen ist die Zahl der Neurotransmitter wesentlich größer als im peripheren System, zum anderen sind die Neurone, die bestimmte Neurotransmitter bilden, meist in vielen Regionen des Nervensystems lokalisiert und ihre Fortsätze innervieren sehr große Areale des Gehirns. Schließlich ist der Nachweis der NTM-Systeme nicht immer einfach zu führen.
Wenn von NTM-Systemen gesprochen wird, meint man meist nicht die Axone, die sich histologisch mittels klassisch-anatomischen Untersuchungsmethoden (z.B. der Markscheidentechnik, bzw. der Silberimprägnation) nachweisen lassen, sondern solche mit besonderen morphologischen und topographischen Charakteristika:
1. die Ursprungsneurone liegen meist nicht zu kompakten Kernen angeordnet sind, sondern verstreut,
2. die Axone gehören zu den dünnsten innerhalb des ZNS und sind (daher) marklos,
3. die Axone ziehen ungeachtet der bekannten Organisationsprinzipien durch das ganze Gehirn (verhalten sich also nicht wie die "typischen" Projektionsmeurone) und verteilen sich dabei teilweise ohne erkennbaren Richtungsbezug innerhalb der gesamten Neuraxis. Die innerhalb der Neuraxis auf- und absteigenden sog. Neurotransmitterbahnen stellen also keine umschriebenen Bündel im Sinne von
Fasciculi oder Tractus dar, sondern sind eher als lose Ansammlungen nur streckenweise gemeinsam verlaufender Fasern aufzufassen.
4. Während der gesamten Verlaufsstrecke des Axons fallen knoten- oder spindelförmige Auftreibungen auf, die diesen Fasern ein perlschnurartiges Aussehen verleihen.
5. Bereits in kurzem Abstand vom Soma, besonders aber im Bereich der präterminalen Strecke erfolgt eine sehr intensive Aufzweigung der Fasern (deren Gesamtlänge infolge dessen mehr als das hundertfache des Abstandes von der Ursprungszelle erreichen kann). Dies führt zu einer extrem hohen Synapsenhäufigkeit pro Neuron, die bis ca. eine halbe Million im Einzelfall betragen soll. Die hier im Bereich der Endigung vorkommenden Auftreibungen der terminalen Varikositäten unterscheiden sich ultrastrukturell nicht von den axonalen Auftreibungen. Alle enthalten, abhängig von der Qualität der Bahnen, unterschiedliche Vesikelpopulationen. Membrandifferenzierungen allerdings, die als Ausdruck einer synaptischen Spezialisierung gedeutet werden können, finden sich bei allen untersuchten (monoaminergen) Systemen, auch bei elektronenmikroskopischer Serienschnittanalyse nur in ca. 5 %. Es ist daher bisher ungeklärt, ob es sich bei all diesen Strukturen um Synapsen handelt, oder um das Äquivalentbild etwa einer quasi fixierten Proportionsbewegung.
6. die Synapsen sind selten "fokusiert".
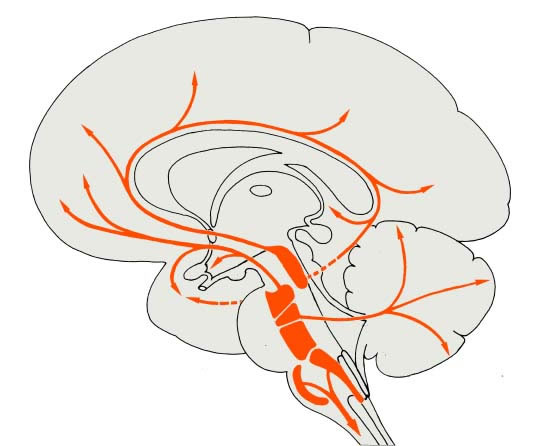
Diese Neurotransmittersysteme sind als ein phylogenetisch sehr altes System aufzufassen, das aus einer recht bescheidenen Anzahl von Nervenzellkörpern besteht. Bei der Ratte z.B. liegt sie in der Grössenordnung von nur einigen 10000 Zellen. Im LC der Ratte, wo ca. 60 % der NE-Neurone liegen, sollen nur etwa 1500 NE-Zellen gelegen sein. Aus diesem diskreten Ursprungsgebiet leitet sich ein aussergewöhnlich grosses umfängliches Verzweigungsgebiet (der Neutrotransmitter-transportierenden Axone) ab. Je nach der Art des beteiligten Neurotransmitters werden entweder sehr umschriebene subcorticale und corticale Areale - wie z.B. durch das serotoninerge und das dopaminerge System - oder z.B. diffus alle corticalen Areale, wie durch das noradrenerge dorsale System beeinflusst.
2. Liste der wichtigsten NTM
Vielfach handelt es sich bei dem NTM um ein Monoamin, das in den Nervenzellen durch geringfügige Veränderung einer Aminosäure entsteht. Manchmal dient sogar die Aminosäure selbst als Botenstoff.
Die wichtigsten Neurotransmitter finden sich in folgender Tabelle:
3. Topographie der NTM-Systeme und ihre Verbindungen
Die Begriffe cholinerge, noradrenerge, serotonerge, dopaminerge, usw. Neurone repräsentieren Komponenten von Neurotransmittersystemen, die meist in umschriebenen Regionen des Nervensystems lokalisiert sind. Die Lage der NTM-produzierenden Neurone ist recht spezifisch, der Verlauf der Axone und deren Verbreitungsgebiet unterschiedlich, aber meist sehr komplex. Die cholinergen Neurone finden sich in meist lokal umschriebenen Zellgruppen über das gesamte ZNS verteilt. Der quantitativ grösste Teil der Nervenzellkörper der (monoaminergen) Systeme lässt sich im Hirnstamm lokalisieren und dort bevorzugt in den phylogenetisch alten Arealen der Formatio reticularis.
Als wichtigste monoaminerge Systeme gelten:
1. das nigrostriatale DA-System, das bei der Parkinson'schen Erkrankung eine grosse Rolle spielt,
2. das sog. mesolimbische DA-System,
3. ein dorsales und ein ventrales periventriculäres NA-System und
4. das serotoninerge aufsteigende System der sog. Raphekerne.
Von derartigen Nervenzellgruppen gelangen aufsteigende Axone zu einer Reihe subcorticaler Kerne sowie zu corticalen Arealen; absteigende Axone enden (meist) über die Gesamtausdehnung des Rückenmarks. Die Lage der Neurotransmitterbahnen ist abhängig von der Art der beteiligten Neurotransmitter.
3.1 Azetylcholin
Neurone, die Azetylcholin als NTM verwenden, werden als cholinerg (parasympathomimetisch) bezeichnet. Die cholinergen Neurone im NS des Menschen können anatomisch in folgende 3 Hauptkategorien eingeteilt werden:
1. Neurone des peripheren NS: Alle parasympathischen postganglionären Neurone.
2. Neurone, deren Soma im ZNS, deren Projektionsgebiet im peripheren Nervensystem liegt: Hierzu gehören die somato- und branchio-motorischen Ursprungsneurone (untere Motoneurone) und die viscero-motorischen Neurone (präganglionäre autonome Neurone in der intermediolateralen Zellsäure des Rückenmarkes, sowie Hirnnerven).
3. Neurone, deren Soma und Versorgungsgebiet innerhalb des ZNS liegen.
Hierzu gehören sowohl Interneurone (große Striatumzellen) als auch Projektionsneurone. Die wichtigsten zu dieser Gruppe gehörigen Areale werden
a. vom cholinergen System des basalen Vorderhirns und
b. vom cholinergen System des Hirnstammes gebildet.
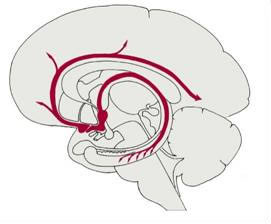
a., Das cholinerge System des basalen Vorderhirns:
Dieses System entspricht dem Basalkernkomplex, der sich aus der Area septi medialis (= Ncl. diagonalis) und Ncl. basalis zusammensetzt. Seine großen, hyperchromatischen Neurone erstrecken sich von der mittleren Septalregion bogenförmig entlang der mediobasalen Oberfläche des Gehirns bis in die Substantia innominata. Dort liegen sie unterhalb von Globus pallidus und Putamen. Das Projektionsgebiet liegt im Hippocampus, Bulbus olfactorius sowie Kortex und Mandelkern.
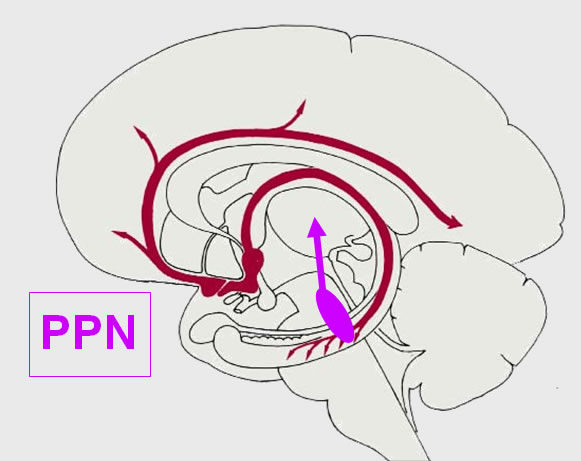
b., Das cholinerge System des Hirnstammes: Die Zellen dieses Systems liegen in der pontomesencephalen Formatio reticularis (seitlich des Ncl. ruber und dorsal des Lemniscus medialis). Sie projizieren hauptsächlich zum Thalamus. Der wichtigste Kern ist der Ncl. (tegmenti)pedunculo-pontinus (PPN). Eine Erregung dieser Zellen führt zur Aktivierung der unspezifischen Thalamuskerne und führt zu einer Förderung der trans-thalamischen kortikopetalen Transmission.
Funktion:
1. Aus der Tatsache, daß die somatomotorischen und viszeromotorischen Neurone cholinerger Natur sind, erklären sich motorische und viszerale Effekte bei einer Beinträchtigung cholinerger Funktionen.
2. Die cholinerge Versorgung des Kortex durch die Neurone in der basalen Vorderhirnregion scheint für zahlreiche Verhaltensweisen (Schlaf, Bewegungsverhalten, Aggression, Lernen, Gedächtnis und Motivation) wichtig.
3. Die cholinergen Neurone in der Formatio reticularis der pontomesencephalen Region gehören zum zentralen aktivierenden System. Eine Erregung dieser Zellen führt zur Aktivierung der unspezifischen Thalamuskerne und führt zu einer Förderung der trans-thalamischen kortikopetalen Transmission (siehe Kap. 11).
Angewandte Anatomie:
Die Verteilung cholinerger Neurone im NS ist sehr weitläufig. Hieraus folgt, daß sich kein spezifisches klinisches Erscheinungsbild allein einem Defekt cholinerger neuronaler Aktivität zuschreiben läßt. Doch gibt es mehrere neuro-degenerative Krankheitsbilder, bei denen cholinerge Neurone betroffen sind. Besonders wichtig sind die cholinergen Neurone im Ncl. basalis, da ihr Verlust mit verminderter mentaler Kapazität einhergeht. Das Ausmaß an Zellschwund im Ncl. basalis scheint mit dem Grad der Reduktion von Azetylcholin im Kortex und mit dem Verlust intellektueller Leistung zu korrelieren.
3.2 Noradrenalin und Adrenalin
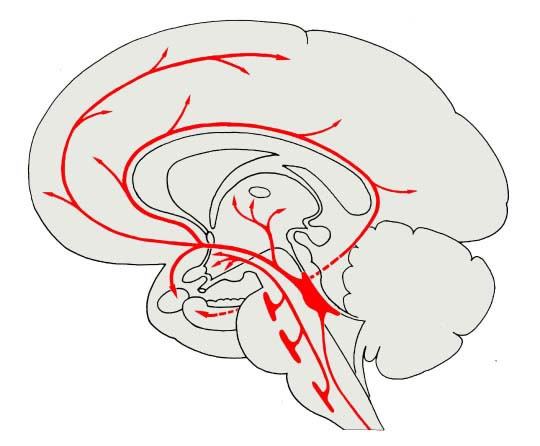
Die Noradrenalin (NE)-produzierenden Zellen liegen (fast ausschließlich) im unteren Hirnstamm. Dort bilden sie 3 Hauptgruppen:
1. Das Locus coeruleus-Gebiet.
2. Das laterale tegmentale Zellsystem (mit je einem medullären und einem pontinen Teil).
3. Die dorsale medulläre Zellgruppe.
Obgleich die Gesamtzahl der NE-produzierenden Zellen im Gehirn nur einige Tausend beträgt, umfaßt ihr Projektionsgebiet das gesamte Gehirn und Rückenmark. Die Aufgaben dieses Systems sind bis heute nicht klar. Einige noradrenerge Fasern enden an kleinen Blutgefäßen und Kapillaren innerhalb des Gehirns, woraus eine mögliche Rolle bei der Regulation des zerebralen Blutstromes abzuleiten ist. Möglicherweise stellt das zentrale noradrenerge System auch einen Bestandteil des aufsteigenden aktivierenden retikulären Systems (ARAS) dar und absteigende Fasern aus dem Ncl. coeruleus zum Rückenmark beteiligen sich möglicherweise an der Bewegung. Schließlich haben physiologische und psychophysische Untersuchungen eine Beteiligung des noradrenergen Systems an psychischen Zuständen wie Stimmung und Gemütsverfassung sowie an Gedächtnis, hormonaler Regulation und anderen Prozessen angedeutet.
Adrenalin: Die adrenergen Zellgruppen umfassen nuir wenige Zellen. Ihre Funktion noch weitgehend ungeklärt. Daher soll hier nur eine kurze Zusammenfassung gegeben werden.
1. Eine Zellgruppe (CA1) befindet sich im ventrolateralen Myelencephalon und erstreckt sich zwischen unterem Olivenkomplex und dem Ncl. reticularis lateralis. Aus ihm entwickeln sich aufsteigende Verbindungen, die im sog. ventralen NE-Bündel über die Formatio reticularis, der Area tegmenti ventralis in die laterale Hypothalamusregion führen. Diese Verbindungen steuern den Ncl. paraventricularis und Ncl. dorsomedialis hypothalami an. Über den Ncl. paraventricularis üben diese Fasern einen Einfluß auf die Oxytozin- und Vasopressinsekretion aus; über den Ncl. dorsomedialis hypothalami gewinnen sie Einfluß auf die Essensaufnahme (Hungergefühl).
2. Andere Zellgruppen (CA2 und CA3) befinden sich in der Nachbarschaft vom Ncl. solitarius, sowie eingestreut zwischen den Bündeln des Fc. longitudinalis medialis. Sie üben wahrscheinlich über den Ncl. solitarius und Ncl. dorsalis nervi vagi Einfluß auf Blutdruck und Atmung aus.
3.3 Dopamin
Entsprechend der Länge der efferenten Dopaminfasern lassen sich 3 Systeme unterscheiden.
1. Ultrakurze Systeme: Zu diesen gehören Neurone in der Retina.
2. Mittellange Systeme: Hierzu rechnen
a, das Tubero-hypophysäre dopaminerge System, das vom Ncl. infundibularis und von der periventrikulären Zone zum Infundibulum zieht (Tubero-infundibuläres System).
b. das Incerto-hypothalamische System, das den dorsalen und hinteren Hypothalamus mit dem vorderen Hypothalamus und den seitlichen Septumkernen verbindet.
c. die medulläre periventrikuläre Gruppe, die sich aus Zellen zusammensetzt, die um den Ncl. tractus solitarius und in der tegmentalen Strahlung des zentralen Höhlengraus liegen.
3. Lange Systeme: Die langen Systeme entwickeln sich aus den dopaminergen Zellgruppen der Area tegmenti ventralis und der Substantia nigra und projezieren hauptsächlichen zu folgenden drei Zielgebieten: a, Neostriatum, b, limbischer Cortex (medialer präfrontaler Cortex, Cortex cinguli, Cortex piriformis, Cortex entorhinalis) und c, limbische Vorderhirnregion (Septumregion, Tuberculum olfactorium, Ncl. accumbens, Mandelkernkomplex). Die beiden letzten Gruppen werden allgemein als meso-corticales und meso-limbisches dopaminerges System bezeichnet.
Funktion: Das nigrostriatale dopaminerge System spielt eine wichtige Rolle in der Regulation von Haltungsreflexen und der Hemmung motorischer Aktivität. Die motorischen Störungen bei der Parkinson'schen Erkrankung (besonders die Akinesien) werden auf einen Verlust dopaminerger Neurone in der Zona compacta der Substantia nigra zurückgeführt (siehe Kapitel 13). Der Mangel an Dopamin in der Substantia nigra führt zu einer Mangelsituation im Striatum und damit zu einer Störung des cholinergen-dopaminergen Gleichgewichtes. Im Gegensatz hierzu führt ein Überschuß an Dopamin im Striatum (u.a. bedingt durch eine Degeneration cholinerger Neurone im Striatum) zu einem Ausfall der Hemmung auf die Substantia nigra und den Globus pallidus und es kommt zur Symptomatik der Chorea.
Ein verminderter Einfluß dieser nigro-striatalen Neurone wird auch mit Dyskinesien in Verbindung gebracht, die nach der Applikation antipsychotischer Medikamente, die dopaminerge Rezeptoren blockieren, betreffen.
Das meso-limbische dopaminerge System (Projektion in das limbische Vorderhirn) greift wahrscheinlich in das emotionale Verhalten ein. Das mesocorticale System scheint eine Rolle bei kognitiven Funktionen zu spielen. Es dient als Verstärker von Aktivierungsreizen. Beide, das meso-limbische und das meso-corticale Dopaminsystem scheinen in der Pathophysiologie der Schizophrenie eine Rolle zu spielen. Die Projektionsorte (Rezeptoren) beider Systeme sind auch ist auch das Ziel therapeutischer Intervention mit antipsychotischen Medikamenten.
Das tubero-infundibulare Dopaminsystem spielt eine wichtige Rolle bei der Regulation der Freisetzung von Prolactin, Luteinisierungshormon, und möglicherweise auch von Wachstumshormon aus der Adenohypophyse.
Dopamin dient als Verstärker der Aktivierungsquelle. Die Unterbindung seiner Wirkung durch eine Zerstörung in der Formatio reticularis oder der Bahnverbindungen erklärt viele frühere Ergebnisse von Läsionsstudien.
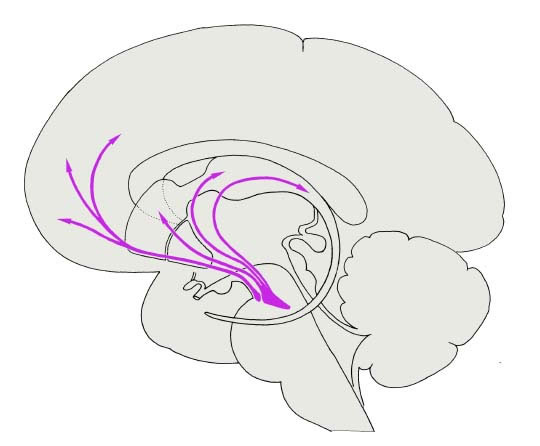
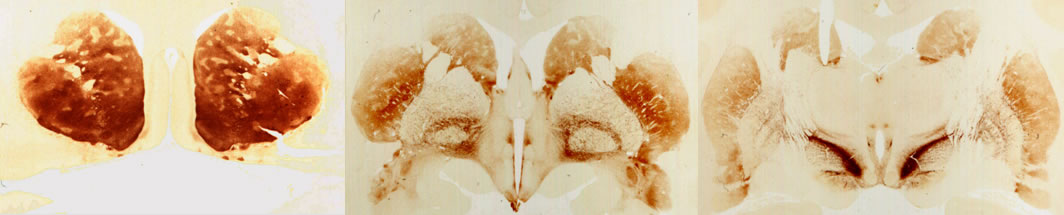
3.4 Serotonin
Die Ursprungsgebiete serotoninerger Neurone befinden sich in den Raphekernen (Abb. 21-9). Die Raphekerne des Hirnstamms können in mindestens 8 Komponenten eingeteilt werden (Ncl. R. pallidus, - obscurus, - magnus in der Medulla oblongata; Ncl. R. pontis und Ncl. centralis superior in der Brücke; Ncl. R. dorsalis, - linearis intermedius und - linearis rostralis im Mittelhirn).
Verbindungen: 1. Absteigende Axone entspringen hauptsächlich aus dem Ncl. R. pallidus, obscurus, magnus und pontis. Sie verlaufen im dorsalen und ventralen Teil des Seitenstrangs und im Ventralstrang.
Ursprungsort der aufsteigenden Projektionen serotoninerger Zellen sind Ncl. R. dorsalis und medianus.
Funktion: Das Raphe-spinale System ist eine Komponente des endogenen Schmerzsystems. Die Reizung der Ursprungsneurone bewirkt Analgesie bei wachen Individuen. Dieser analgetische Effekt wird bei der operativen Schmerzbekämpfung ausgenutzt.
Serotonin ist eine vasoaktive Substanz und es wird vermutet, daß der Serotoninstoffwechsel bei einigen Migräneformen abnorm verläuft, was auf Spasmen der Koronargefäße zurückgeführt werden kann.
Es scheint, daß Serotonin eine Schlüsselstellung bei der Regulierung der Gemütslage einnimmt. Serotonin erzeugt ein allgemeines Wohlbefinden bis hin zum freudigen Hoch. Steht Serotonin dem Limbischen System nicht in ausreichender Menge zur Verfügung, "sinkt der Mensch in dumpfes Unglück".
Serotonin spielt auch eine Schlüsselrolle bei der Regulation des Schlafrhythmus. Auch Melatonin, das in der Zirbeldrüse (zirkumventrikuläres Organ !) aus Serotonin gebildet wird, besitzt schlafinduzierende Wirkung.
Legende
a, Azetylcholin,
b, Dopamin,
c, Noradrenalin,
d, Serotonin.
Abk.:
1, Basalkernkomplex (Ncl. diagonalis, Ncl. basalis), 2, Substantia nigra, pars compacta, A9, 3, Area tegmentalis ventralis, A10, 4, Locus coeruleus, 5, Serotonerge Zellgruppen ( B1 = R. pallidus, B2 = R. obscurus, B3 = R. magnus, B5 = R. pontis, B7 = R. dorsalis, B8 = Ncl. centralis sup., B9 = mesencephale Gruppe)
3.5 Gamma-Amino-Buttersäure (GABA)
GABA gilt als der im menschlichen Gehirn stärkste und weitest verbreitete inhibitorische NTM. Etwa 30-40% aller zerebralen Rezeptoren sind GABA-Rezeptoren. Die NTM-Rezeptor-Interaktion verbessert die Ionenleitfähigkeit der postsynaptischen Membran für Chloridionen. Der verstärkte Cl--Influx hyperpolarisiert die postsynaptische Membran und hemmt die Impulsweiterleitung. Benzodiazepine (Tranquilizer) potenzieren diese Wirkung. GABA findet sich u.a. im Kortex, Hippocampus, Kleinhirn, den Basalganglien und bei den präsynaptischen Hemmungssynapsen (siehe dort).
3.6 Glyzin
Ein weiterer hemmender NTM ist Glyzin, das als spinaler NTM in den Renshaw-Zellen des Vorderhorns auftritt.
3.7 Glutamat
Man rechnet damit, daß die Hälfte aller Synapsen im Gehirn Glutamat als NTM einsetzt. Beispiele bilden die Pyramidenzellen im Kortex und die meisten Synapsen innerhalb des Hippocampus (Tr. perforans), sowie im Fornix.
4. Funktionelle Wechselbeziehungen zwischen NTM
Die NTM-Systeme können nur in ihrer Wechselbeziehung zueinander verstanden werden können.
Ein Beispiel:
Die Stimulation des aufsteigenden DA-Systems leitet offenbar einen "Aktivierungskomplex" ein, deren in engem Zusammenhang zu nahrungsbezogenen Stimuli steht. ("Incentive-Effekt", motorische "Einstellbereitschaft").
Die Stimulation des dorsalen NA-Systems führt wahrscheinlich zur Stabilisierung solcher neuronalen Verschaltungsmuster, die bei erfolgreicher Triebbefriedigung verwendet wurden ("Confirming reaktion", Thorndike, 1933; "Now print" mechanism, Livingston, 1967).
Die Aktivierung beider genannter Systeme bewirkt eine Veränderung des Verhaltensmusters, die gewährleisten soll, dass die auf Befriedigung drängenden, im wesentlichen auf Nahrungsaufnahme bezogenen, Stimuli auch tatsächlich befriedigt werden (damit durch Stabilisierung von Entwurfs- oder Ausführungsprogrammen eine organisatorische Erleichterung geschaffen wird). Das ventrale NA-Bündel ist offenbar mit einem Sättigungsmechanismus korreliert; seine Aktivierung löst im Gegensatz zu beiden vorher genannten
Systemen keine Belohnungseffekte aus.
Das serotoninerge (5-HT-) System übt offenbar hemmende Impulse auf das motorische Verhalten aus und vermittelt möglicherweise einige der Unterdrückungsmechanismen auf aversive Reize. (Die enge topographische Beziehung und die intensive Verflechtung mit dem CA-System weisen auf ein auf dem CA-System entgegengerichtetes System hin, das im Sinne eines Bestrafungs- und Abwehrmechanismen korrelierendes System aufzufassen wäre.)
5. Zusammenfassung und Ausblick
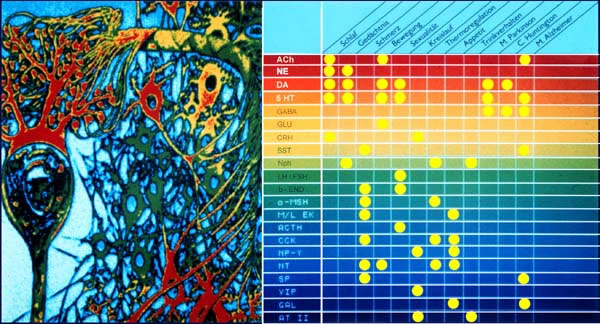
Die Beziehung einiger Neurotransmitter zu physiologischen Vorgängen und einigen Krankheiten ist stark schematisch und teilweise spekulativ in folgender Tabelle zusammengefaßt (siehe Lehrbücher der Neurochemie).
Tabelle 21-2: Die Beziehung einiger Neurotransmitter zu physiologischen Vorgängen und einigen Krankheiten.
Physiologische Funktionen: |
ACh | NE | DA | 5-HT | GABA | Glu |
| Aufmerksamkeit und Schlaf | + | + | + | + | ||
| Lernen und Gedächtnis | + | + | + | |||
| Schmerz | + | |||||
| Bewegung | + | + | + | + | ||
| Sexualität | + | + | ||||
Pathophysiologie: |
||||||
| Morbus Alzheimer | + | + | ||||
| Morbus Parkinson | + | + | ||||
| Morbus Huntington | + |